Observação: Esta matéria é parte de uma sequência.
Caso não tenha lido a primeira parte, leia-a aqui.
Na semana passada, estabelecemos as bases: entropia, conservação de energia e o fato de que não se cria energia a partir do nada. Agora, vamos colocar a mão na massa — ou melhor, no processo industrial. Acompanhe conosco cada etapa da produção do combustível sintético: da captura do CO2 no ar à eletrólise da água, da síntese dos hidrocarbonetos à contabilidade final da energia gasta. E, ao final, a comparação definitiva: com a mesma eletricidade, o que rende mais — e-fuel ou carro elétrico?
IV – Fase 1: A Captura do Gás Carbônico.
Dentro do processo de síntese do combustível, antes de realizarmos qualquer transformação química, precisamos obter as matérias-primas em determinado grau de pureza.
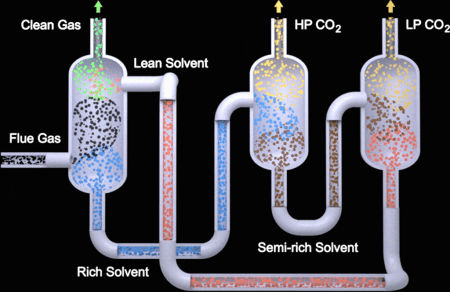
Obter água no grau de pureza é fácil, mas o mesmo não se aplica ao gás carbônico.
A captura do gás carbônico (CO2) é um processo complexo e que pode variar conforme o processo. Inicialmente temos que considerar que a concentração deste gás na atmosfera é relativamente pequena, da ordem de 0,4% em massa. Esta baixa concentração exige que grandes volumes de ar sejam bombeados para unidades de lavagem, onde um fluido com componentes absorventes são aspergidos, absorvendo este gás carbônico. Após a absorção, estes fluidos absorventes são regenerados, geralmente por aquecimento, liberando o gás carbônico em condições controladas para mantê-lo o mais puro possível para posterior processamento.
Dado que o processo envolve o bombeamento de grandes quantidades de ar e do fluido absorvente, bem como aquecimento em diversas etapas do processo para massas significativas, é natural que haja grande consumo de energia nesta fase do processo de produção do combustível, sem que haja qualquer fixação desta energia no combustível posteriormente sintetizado, piorando o balanço energético de formação deste combustível.
Com isso, fica claro que nenhum processo químico real opera sem perdas — resta agora analisar de onde vem a energia envolvida na produção dos combustíveis sintéticos.
V – Fase II: A Eletrólise da Água
Para a produção do combustível sintético será necessário obter hidrogênio e oxigênio moleculares.

Hoje, a maior produção de hidrogênio molecular é feita através da reforma de gás metano (CH4) fóssil. Como o metano pode ser queimado na presença de oxigênio, energeticamente ele está num nível mais elevado que a água, sendo necessário menos energia para obtenção do hidrogênio do que fazendo a hidrólise da água, tornando o processo economicamente mais viável em escala industrial.
No entanto, a reforma do metano obriga a emissão de gás carbônico para a atmosfera.
A forma de se evitar a emissão indesejável de carbono para obter hidrogênio molecular é através da eletrólise da água, onde não há carbono envolvido, usando energias renováveis. Este é o chamado “hidrogênio verde”.
No entanto, o custo energético e econômico deste processo é elevado.
A eficiência deste processo em eletrolisadores de alta eficiência situa-se entre 75 e 85% da energia elétrica aplicada em relação à energia química armazenada no hidrogênio, com o restante 15 a 25% desta energia sendo perdida na forma de calor e outras ineficiências do processo.
De forma semelhante, a eletrólise da água não cria energia, mas converte energia elétrica em energia química, com perdas inevitáveis ao longo do processo.
VI – A Síntese dos Hidrocarbonetos
As principais rotas para a produção de combustíveis sintéticos a partir de hidrogênio e carbono incluem o processo Fischer-Tropsch, que permite a formação de cadeias de hidrocarbonetos de diferentes comprimentos, e o processo de Sabatier, que resulta predominantemente na produção de metano, razão pela qual é frequentemente denominado processo de metanização.
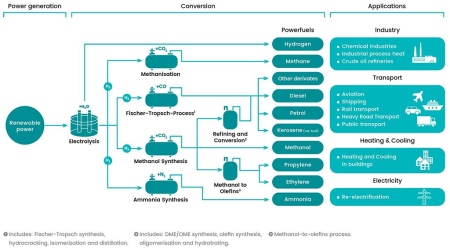
Ambos são processos catalíticos nos quais o hidrogênio molecular reage com o dióxido de carbono. No caso dos combustíveis líquidos sintéticos (e-fuels), o dióxido de carbono (CO2)
é inicialmente convertido em monóxido de carbono (CO) por reações auxiliares, e este, por sua vez, reage com o hidrogênio no processo Fischer-Tropsch, formando hidrocarbonetos progressivamente mais complexos, compatíveis com combustíveis automobilísticos líquidos.
Considerando a seletividade real para frações líquidas, as reações auxiliares e as perdas térmicas e termodinâmicas inerentes ao processo químico, a eficiência energética global da conversão de hidrogênio e CO2 em combustível líquido situa-se tipicamente na faixa de 55 a 60%.
VII – A Contabilidade das Energias
Vamos considerar a densidade energética de um litro de combustível sintético utilizado na Fórmula 1, avaliada em aproximadamente 42 MJ/L.
Observação metodológica:
Para fins de análise energética comparativa, considera-se que toda a energia química armazenada no combustível sintético tem origem, direta ou indireta, na energia elétrica utilizada para a produção do hidrogênio. O carbono capturado do CO2 atmosférico não contribui com energia química líquida ao balanço, atuando apenas como elemento estrutural do combustível. As contribuições energéticas associadas à captura e ao processamento do carbono e do oxigênio são consideradas de segunda ordem e são tratadas separadamente.
Do ponto de vista termodinâmico, o carbono proveniente do CO2 encontra-se em estado de oxidação máxima e não representa uma fonte líquida de energia química, sendo necessário investimento energético adicional para sua redução.
Produção do hidrogênio
A produção de hidrogênio por eletrólise da água consome tipicamente entre 50 e 55 kW·h por quilograma de H2 produzido, o que corresponde a aproximadamente 180 a 200 MJ/kg. Adotando um valor médio de 52,5 kW·h/kg, obtém-se cerca de 189 MJ/kg de H2 .
Um litro de e-fuel possui massa aproximada de 0,75 kg, sendo tipicamente composto por cerca de 85% de carbono e 15% de hidrogênio em massa. Assim, cada litro de combustível contém da ordem de 0,10 a 0,11 kg de hidrogênio efetivamente incorporado.
A produção dessa quantidade de hidrogênio por eletrólise requer, portanto, aproximadamente 19 a 21 MJ de energia elétrica. No entanto, ao longo do processo de síntese, uma quantidade significativamente maior de hidrogênio precisa ser produzida, pois apenas uma fração dele é incorporada ao combustível final. O restante é consumido na remoção do oxigênio do CO2 e convertido em água, sendo descartado do processo.
Considerando o hidrogênio total efetivamente processado ao longo da cadeia industrial, o consumo energético associado à eletrólise situa-se tipicamente na faixa de 90 a 110 MJ por litro de combustível produzido. Para os cálculos a seguir, adota-se o valor médio de 105 MJ/L.
Apenas na etapa de eletrólise, o consumo energético já ultrapassa em cerca de 150% a energia contida em um litro do e-fuel produzido.
O restante é consumido na remoção do oxigênio do CO2 .
, formando água como subproduto, que não integra o combustível final.
Captura do dióxido de carbono (CO2)
A captura direta de dióxido de carbono da atmosfera (DAC) apresenta consumos energéticos típicos da ordem de:
- 0,5 a 1,0 kW·h/kg de CO2 de energia elétrica
- 1,5 a 2,5 kW·h/kg de CO2 de energia térmica
Para a produção de um litro de combustível sintético (~0,75 kg), são necessários cerca de 2,3 kg de CO2 correspondentes à quantidade de carbono incorporada ao combustível.
Isso resulta em um consumo médio aproximado de:
- 6,5 MJ de energia elétrica
- 16,5 MJ de energia térmica
totalizando cerca de 23 MJ associados à captura do carbono atmosférico.
Processos industriais auxiliares
Além da eletrólise e da captura do CO2, o processo industrial envolve diversas etapas auxiliares, como:
- compressão e manuseio do hidrogênio,
- bombeamento de fluidos,
- controle térmico dos reatores,
- separação e purificação dos produtos,
- perdas operacionais e energéticas.
Esses processos consomem tipicamente entre 8 e 12 MJ por litro de combustível produzido. Para esta análise, adota-se um valor médio de 10 MJ/L.
Balanço energético global
Somando-se todas as contribuições energéticas:
- Eletrólise do hidrogênio: ~105 MJ
- Captura de CO2 (elétrica + térmica): ~23 MJ
- Processos industriais auxiliares: ~10 MJ
Energia total investida: ~138 MJ por litro de e-fuel
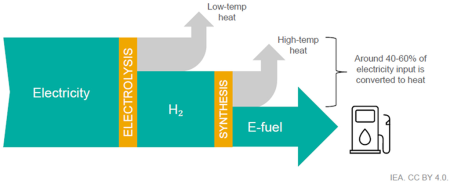
Considerando que o combustível final contém 42 MJ de energia por litro, o rendimento energético global do processo de produção situa-se em torno de 30%, o que implica que cerca de 70% da energia originalmente empregada é perdida antes mesmo de o combustível chegar ao tanque do veículo.
É importante notar que esse rendimento ainda não inclui as perdas associadas à conversão dessa energia em trabalho mecânico no motor a combustão.
VIII – Contabilidade de Massas
Embora um litro de e-fuel possua massa aproximada de 0,75 kg, a massa total de reagentes processados ao longo da cadeia de síntese é significativamente maior.
Apenas o carbono proveniente do CO2 e uma fração do hidrogênio produzido por eletrólise são efetivamente incorporados ao combustível final. A maior parte do hidrogênio é utilizada na remoção do oxigênio do CO2 e convertida em água, que é descartada do processo. De forma análoga, todo o oxigênio removido do CO2 e da água utilizada na eletrólise não integra o combustível final.
Essa discrepância entre a massa total processada e a massa final do combustível é inerente a processos de redução química e não representa uma inconsistência nos cálculos energéticos, mas sim uma consequência direta da estequiometria e da termodinâmica envolvidas na síntese de hidrocarbonetos a partir de CO2 e hidrogênio.
IX – Comparação com Veículos Elétricos a Bateria
Para que a comparação entre combustíveis sintéticos e veículos elétricos seja fisicamente consistente, ambos os sistemas são avaliados a partir da mesma quantidade de energia elétrica disponível no ponto de consumo, ou seja, após a geração e a transmissão. Dessa forma, eventuais perdas a montante da rede elétrica são comuns aos dois casos e não influenciam o resultado comparativo.
Conforme demonstrado anteriormente, a produção de 1 litro de e-fuel, contendo aproximadamente 42 MJ de energia química, requer da ordem de 138 MJ de energia elétrica e térmica disponíveis na unidade fabril de produção.
A seguir, avalia-se o que essa mesma quantidade de energia elétrica permitiria realizar quando utilizada diretamente para a propulsão de um veículo elétrico a bateria.
Uso da energia num veículo elétrico
O processo de carregamento da bateria, incluindo o carregador embarcado e as perdas internas da bateria, apresenta rendimento típico entre 90 e 95%. Adotando um valor médio de 92%, cerca de 127 MJ dos 138 MJ disponíveis são efetivamente armazenados na bateria do veículo.
O conjunto inversor–motor elétrico apresenta rendimento elevado, tipicamente entre 90 e 95% em regime de uso real. Considerando um rendimento médio conservador de 90%, a energia mecânica efetivamente entregue às rodas é da ordem de 114 MJ.
Uso da energia via combustível sintético
No caso do e-fuel, os 42 MJ contidos em um litro de combustível ainda precisam ser convertidos em trabalho mecânico por meio de um motor a combustão interna. Mesmo em condições favoráveis, motores de ciclo Otto operando com combustíveis líquidos apresentam rendimento médio em uso real da ordem de 25 a 30%.
Adotando um valor otimista de 30%, a energia mecânica efetivamente disponível nas rodas é da ordem de 13 MJ por litro de combustível.
Resultado comparativo
Utilizando a mesma quantidade de energia elétrica disponível no ponto de consumo (138 MJ):
- Veículo elétrico:
- Energia mecânica nas rodas: ~114 MJ
- Veículo a e-fuel:
- Energia mecânica nas rodas: ~13 MJ
Isso indica que, sob as mesmas condições energéticas de entrada, um veículo elétrico é aproximadamente de 8 a 9 vezes mais eficiente do que um veículo a combustão alimentado por combustível sintético.
Os valores adotados a seguir são conservadores e favoráveis ao combustível sintético, de modo a evitar conclusões exageradas.
Interpretação física
Essa diferença decorre do número de conversões energéticas envolvidas. O veículo elétrico converte a energia elétrica em movimento com poucas etapas intermediárias, enquanto o combustível sintético exige múltiplas conversões químicas e térmicas antes de produzir trabalho mecânico, cada uma delas sujeita a perdas termodinâmicas inevitáveis.
Conclusão
Do ponto de vista estritamente energético, a rota eletricidade x combustível sintético x motor a combustão apresenta eficiência global significativamente inferior à eletrificação direta. Sempre que a eletrificação direta for tecnicamente viável, o veículo elétrico oferece uma utilização muito mais eficiente da energia elétrica disponível.

Considerações sobre a Fórmula 1
Diante da análise apresentada, é pouco plausível supor que os engenheiros e dirigentes da Fórmula 1 desconheçam as limitações energéticas inerentes aos combustíveis sintéticos. A categoria reúne alguns dos mais avançados centros de excelência em engenharia automobilísica e energética, plenamente cientes das perdas associadas à rota eletricidade/e-fuel x motor a combustão.
A adoção dos e-fuels pela Fórmula 1 deve, portanto, ser compreendida no contexto específico da categoria. Trata-se de um ambiente de consumo energético irrelevante em termos globais, no qual critérios simbólicos, regulatórios e de identidade técnica têm peso maior do que a eficiência energética sistêmica.
Nesse sentido, o uso de combustíveis sintéticos na Fórmula 1 não constitui uma validação de sua aplicação em larga escala na mobilidade leve, mas sim uma escolha coerente com as particularidades de um laboratório tecnológico e de comunicação, cujo contexto não é diretamente transferível para o transporte rodoviário convencional.
Assim, os e-fuels devem ser compreendidos como uma solução de nicho, adequada a contextos específicos onde a densidade energética, a compatibilidade com motores existentes e o simbolismo regulatório são prioritários — mas não como uma resposta escalável aos desafios energéticos da mobilidade de massa.
Ao final desta análise, fica claro que os e-fuels não são uma solução mágica. Do ponto de vista energético, são um desastre: 70% de toda a energia investida se perde antes mesmo de o combustível chegar ao tanque. Depois, o motor a combustão desperdiça mais 70% do que sobrou. O resultado é que, com a mesma eletricidade, um carro elétrico anda até nove vezes mais. Os e-fuels podem até fazer sentido na Fórmula 1 — um ambiente simbólico, de consumo irrelevante em escala global. Mas como solução para a mobilidade de massa, infelizmente, são só isso: uma ilusão.
AAD




